Problématique: Vous avez une impureté qui sort des spécifications au cours d’une étude de stabilité.
Il faut disposer de l’information sur les quantités d'impuretés détectées dans l'étude de stabilité en cours « stability threshold ». Et connaissant la dose maximale journalière (MDD) du médicament, comparer la valeur du seuil de stabilité à celle de la limite ICH Q3B.
- Si % stabilité < % limite ICH Q3B → pas d’évaluation
- Si % stabilité > % limite ICH Q3B → évaluation toxicologique
Évaluation toxicologique et analyse du risque
Détermination du profil toxicologique de l’impureté (CMR, toxicité aigüe, toxicité chronique, etc.) en étudiant les données bibliographiques ou en utilisant les modèles in silico (QSAR, Read-across) : une valeur de NOAEL ou de LOAEL sera choisie.
- Calcul de la limite toxicologique, Permitted Daily Exposure, PDE
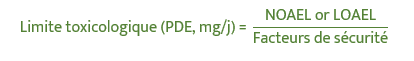
- Connaissant le seuil toxicologique (PDE) et la MDD, la nouvelle spécification peut être calculée comme suit:

Vous pouvez consulter la méthodologie ToxBy.Design pour les Monographies PDE/EJA, qui sont dûment validées et signées par un Expert Toxicologue Européen Agréé.
Dans le cas où vous réalisez cette demande pour la fabrication en scale-up GMP de composés innovants, sachez que ToxBy.Design est dûment accrédité Crédit Impôt Recherche CIR.
N’hésitez pas à nous contacter via la Demande de Cotation ci-dessous pour recevoir un devis pour des Monographies PDE/EJA pour des Substances Actives, des Nouvelles Entités Chimiques ou Biologiques ou autres Substances Chimiques employées dans vos lignes de fabrication BPF.