L’approche de ToxBy.Design pour requalifier les impuretés hors spécifications (ICH Q3A/B, Pharmacopée) consiste à tirer parti des nouvelles options réglementaires introduites dans la ligne directrice ICH M7 pour améliorer la limite de spécification, dans les cas suivants :
Premier cas : Nouveaux principes actifs ou nouveaux médicament, tant au cours de leur développement clinique que lors des demandes ultérieures de commercialisation.
Deuxième cas : Pour les variations de produits déjà commercialisés, ainsi que pour les soumissions de nouvelles demandes de mise sur le marché de médicaments contenant des substances actives présentes dans un médicament déjà approuvé, mais uniquement lorsque :
- Les modifications apportées à la synthèse de la substance active conduisent à de nouvelles impuretés ou une augmentation de la spécification pour les impuretés déjà connues.
- Les changements dans la formulation, la composition ou le procédé de fabrication conduisent à de nouveaux produits de dégradation ou augmentation de la spécification pour les impuretés de dégradation déjà connues.
- Des changements d’indication thérapeutique ou de posologie sont apportés, et affectent de manière significative le seuil de risque de cancer.
La méthodologie d’évaluation des risques de ToxBy.Design implique :
Etape 1 − Identification et classification de l’impureté hors spécification à partir :
- revue bibliographique
- études in silico (QSAR)
Etape 2 − Détermination de limites toxicologiques : PDE, AI, TTC, LTL
Etape 3 − Hors spécifications : Calcul du seuil de sécurité
- Lorsque le seuil de sécurité est supérieur à la quantité d’impuretés dans la Dose Journalière Maximale, alors une nouvelle spécification peut être proposée.
- Calcul de la specification:
En connaissant le seuil toxicologique et la dose journalière maximale (DJM) du médicament,
la nouvelle spécification peut être calculée comme suit :
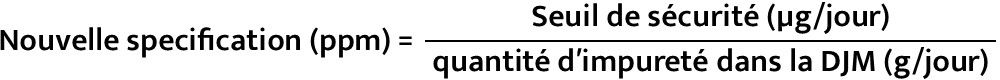
Exemples de cas
Cas 1 : Détermination des spécifications des impuretés d’une nouvelle Substance Active d’une Biotech
Cas 2 : Impureté dans le produit fini
- Non mentionnée dans la monographie EP
- Les données de stabilité indiquant une quantité supérieure à la limite PE
- etc…
Problème : Vous avez une impureté qui sort des spécifications lors d’une étude de stabilité.
Vous devez avoir des informations sur la quantité d’impuretés détectées dans l’étude de stabilité actuelle “seuil de stabilité”, et connaissant la dose journalière maximale (“DJM”) du médicament, comparer la valeur du seuil de stabilité à la limite ICH Q3B.
- Si % d’impureté < % limite ICH Q3B : pas d’évaluation
- Si % d’impureté > % limite ICH Q3B : évaluation toxicologique
La spécification est basée sur une limite d’usage général, elle ne tient pas compte de la toxicité.
Evaluation toxicologique et analyse du risque
Etape 1 − Détermination du profil toxicologique de l’impureté (CMR, toxicité aiguë, toxicité chronique, etc...) en étudiant des données bibliographiques ou en utilisant des modèles in silico (QSAR, read-across) : une DMSENO ou une DMENO sera choisie.
Etpae 2 − Calcul du seuil toxicologique, Permitted Daily Exposure/Exposition Journalière Admissible (“PDE”/“EJA”)

Etape 3 − Connaissant le seuil toxicologique (PDE/EJA) et la DJM, la nouvelle spécification peut être calculée comme suit :
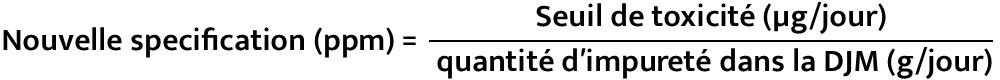
Cas 3 : Libération d’un lot alors qu’une impureté (contaminant, etc...) est détectée
Problème : Votre médicament a une impureté au-dessus des seuils de qualification.
Avec la dose journalière maximale (“DJM”) du médicament, la quantité d’impureté trouvée est comparée à la valeur limite du seuil de qualification ICH Q3B :
- Si % d’impureté < % limite ICH Q3B : pas d’évaluation
- Si % d’impureté > % limite ICH Q3B : évaluation toxicologique
Evaluation toxicologique et analyse du risque
Etape 1 − Détermination du profil toxicologique de l’impureté (CMR, toxicité aiguë, toxicité chronique, etc...) en étudiant des données bibliographiques ou en utilisant des modèles in silico (QSAR, read-across) : une DMSENO ou une DMENO sera choisie.
Etpae 2 − Calcul du seuil toxicologique, Permitted Daily Exposure/Exposition Journalière Admissible (“PDE”/“EJA”)

Etape 3 − Connaissant le seuil toxicologique (PDE/EJA) et la DJM, la nouvelle spécification peut être calculée comme suit :
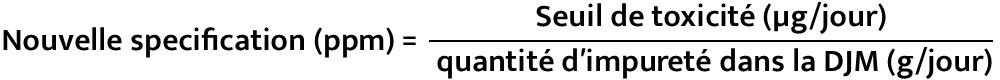
- Si seuil de sécurité > 1 : l’impureté est qualifiée
Vous pouvez consulter la méthodologie ToxBy.Design pour l'Evaluation toxicologique de vos impuretés hors specifications, qui est dûment validée et signée par un Expert Toxicologue Européen Agréé.
Dans le cas où vous réalisez cette demande pour la fabrication en scale-up GMP de composés innovants, sachez que ToxBy.Design est dûment accrédité Crédit Impôt Recherche CIR.
N’hésitez pas à nous contacter via la Demande de Cotation ci-dessous pour recevoir un devis pour l'Evaluation toxicologique de vos impuretés hors specifications, avant ou après l'AMM.