Comment Préparer une Monographie PDE en 5 étapes
Etape 1 − Identification des dangers potentiels
Toutes les données cliniques et non cliniques pertinentes sont examinées.
Etape 2 − Identification des “effets critiques”
Les problèmes de sécurité détaillés dans le Plan de Gestion des Risques du produit final sont examinés afin de détecter d’autres effets critiques chez l’homme.
Les effets critiques chez l’homme identifiés dans des études mécanistiques et des données pharmacodynamiques sont discutés dans le rapport.
Etape 3 – Etablissement d’un Point de Depart pour le calcul de la PDE/EJA:
Une dose maximale sans effet nocif observable (“DMSENO”) correspondant à la dose la plus élevée testée à laquelle aucun effet “critique” ne se produit doit être déterminée pour chaque effet critique identifié.
- Lorsque plusieurs DMSENO sont disponibles,
=> la valeur la plus faible and l'animal le plus sensible sont sélectionnés.
- En l’absence de DMSENO,
=> une Dose Minimale pour Effet Nocif Observable (“DMENO”) peut être utilisée.
Les premières études cliniques de Phase 1 chez l'homme sont examinées afin d’identifier une DMSEO humaine.
La DMSEO chez les volontaires sains est le niveau d’exposition le plus élevé auquel il n’y a pas d’effets (nocifs ou non nocifs) et
est préférable pour calculer une PDE/EJA
plutôt qu’une DMSENO chez les animaux.
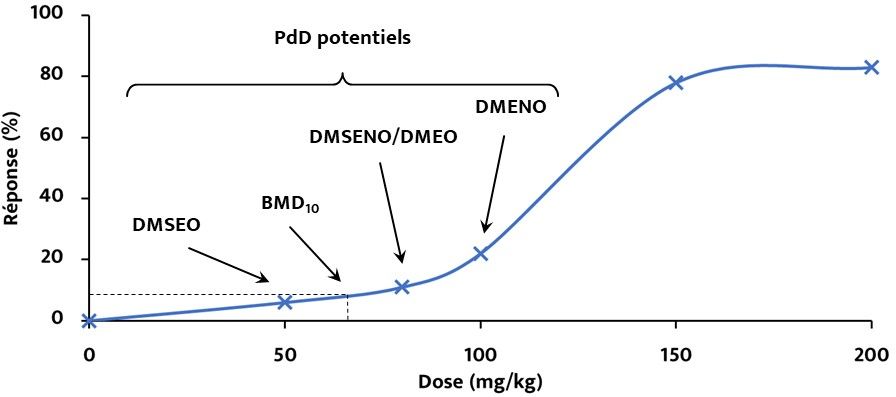
- DMSEO : la plus grande concentration ou quantité de substance qui ne provoque aucun changement dans des conditions d’exposition définies
- DMSENO : la plus grande concentration ou quantité de substance qui ne provoque aucun changement indésirable détectable dans des conditions d’exposition définies
- DMEO : la plus faible concentration ou quantité de substance qui provoque un effet dans des conditions d’exposition définies
- DMENO : la plus faible concentration ou quantité de substance qui provoque un effet nocif dans des conditions d’exposition définies
- BMD10 : dose calculée de manière statistique qui produit un effet indésirable avec une réponse définie (dans ce cas, 10 %)
Etape 4 – Choix des facteurs de correction
Plusieurs facteurs d’ajustement sont utilisés afin de tenir compte de certaines incertitudes.
Les propriétés pharmacocinétiques spécifiques de chaque médicament sont prise en compte pour ajuster le facteur de biodisponibilité.
Etape 5 – Calcul de la PDE/EJA
Tous les articles pertinents et récents publiés concernant les méthodes de calcul de la PDE/EJA sont pris en compte, en plus des lignes directrices de l'EMA; par exemple :
- Lovsin Barle et al. PDE for topical ocular drugs (Pharm Dev Technol. 2018;23(3):225-230)
- Lovsin Barle et al. PDE concept for contaminants of intravitreal (IVT) drugs (Regul Toxicol Pharmacol. 2019;101:29-34)
Pour un API donné :
- tous les paramètres et espèces sensibles sont pris en compte pour calculer les différentes valeurs de PDE/EJA
- le choix de la valeur finale de l’EJA est expliqué
- les effets critiques observés dans les études de toxicité non cliniques sont étudiés afin d’évaluer leur pertinence pour l’homme ou l’animal cible

ToxBy.Design peut développer des monographies PDE/EJA pour des Substances Active ou des Produits Chimiques et fournir des rapports spécifiques pour ces catégories.
Vous pouvez consulter la méthodologie Tox by Design pour les Monographies PDE/EJA, qui sont dûment validées et signées par un Expert Toxicologue Européen Agréé.
Dans le cas où vous réalisez cette demande pour la fabrication en scale-up GMP de composés innovants, sachez que Tox by Design est dûment accrédité Crédit Impôt Recherche CIR.
N’hésitez pas à nous contacter via la Demande de Cotation ci-dessous pour recevoir un devis pour des Monographies PDE/EJA pour des Substances Actives, des Nouvelles Entités Chimiques ou Biologiques ou autres Substances Chimiques employées dans vos lignes de fabrication BPF.